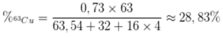Trong tự nhiên đồng có 2 đồng vị 63Cu và 65Cu. Trong đó 65Cu chiếm 27% số nguyên tử .
a) Tính phần trăm khối lượng 65Cu trong tự nhiên
b) Tính phần trăm khối lượng 63Cu trong phân tử Cu2O biết \( \overline{M}\)O = 16
Trong tự nhiên, đồng có 2 đồng vị 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm khoảng 27% về số nguyên tử. Phần trăm khối lượng của 63Cu trong CuCl2
Đồng vị \(^{65}Cu\) chiếm 27% về số nguyên tử.
\(\Rightarrow\)Đồng vị \(^{63}Cu\) chiếm 73% về số nguyên tử.
Số nguyên tử khối:
\(\overline{A_{Cu}}=\dfrac{65\cdot27+63\cdot73}{100}=63,54\)
\(\%m_{^{63}Cu}=\dfrac{63\cdot0,73}{63,54+2\cdot35,5}\cdot100\%=34,18\%\)
Trong tự nhiên, đồng có 2 đồng vị 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm khoảng 27% về số nguyên tử. Phần trăm khối lượng của 63Cu trong CuCl2
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu trong đó đồng vị 65Cu chiếm 27% về số nguyên tử. Phần trăm khối lượng của 65Cu trong CuSO4.5H2O là
A. 7,03.
B. 73.
C. 27.
D. 18,43.
Đáp án D
Phần trăm nguyên tử 63Cu trong tự nhiên là: %63Cu = 100 - 27 = 73%.
Khối lượng nguyên tử trung bình của Cu là:
MCu = 65 x 0,27 + 63 x 0,73 = 63,54
Phần trăm của 63Cu trong CuSO4.5H2O là
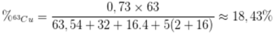
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. biết nguyên tử khối trung bình của Cu là 63,54. Phần trăm khối lượng của 63Cu trong Cu2O là?
A. 73%.
B. 64,29%.
C. 35,71%.
D. 27%.
Đáp án B
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
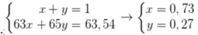
Phần trăm khối lượng của 63Cu trong Cu2O là
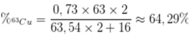
trong tự nhiên đồng có 2 đồng vị 63cu và 65cu .Nguyên tử khối trung bình của Cu là 63,54. a,Tính phần trăm số nguyên tử mỗi loại đồng vị b.Tính thành phần phần trăm theo khối lượng của 65Cu trong CuSO
a)
Gọi thành phần phần trăm của hai đồng vị 63Cu ,65Cu lần lượt là a,b
Ta có :
a + b = 100%
63a + 65b = 63,54
Suy ra a = 0,73 = 73% ; b = 0,27 = 27%
b) Thành phần phần trăm khối lượng của 65Cu trong CuSO4 là :
\(\dfrac{65.27\%}{63,54 + 32 + 16.4 }.100\% = 11\%\)
Câu 1: Trong tự nhiên, nguyên tố đồng có hai đồng vị là 63Cu và 65Cu. Trong đó 65Cu chiếm 27% về số nguyên tử. Số nguyên tử của đồng vị 63Cu trong 7,154 gam Cu2O là? (biết O=16)
Câu 2: Hãy tìm số nguyên tử hidro có trong 6 ml nước. Biết khối lượng riêng của nước là 1 g/ml. (biết O=16; H=1)
Câu 3: Clo có hai đồng vị bền 35Cl(chiếm 75%), 37Cl. Số nguyên tử đồng vị 37Cl có trong 2,22 gam CaCl2 là? (biết Ca=40)
Bài 1: Trong tự nhiên , đồng có 2 đồng vị 65Cu và ACu, trong đó đồng vị 65Cu chiếm 27% về số nguyên tử. Nguyên tử khối trung bình của đồng là 63,54.
a.Tính A.
b.Tính phần trăm khối lượng của 63Cu trong kim loại đồng tự nhiên.
Bài 2: Nguyên tử nguyên tố A có phân mức năng lượng cao nhất là 3s1. Nguyên tử nguyên tố B có cấu hình electron phân lớp ngoài cùng là 3p4. Nguyên tử nguyên tố tố C có tổng số electron ở phân lớp p là 11. Viết cấu hình electron đầy đủ của A, B, C và xác định vị trí của chúng trong bảng tuần hoàn.
Bài 3: Cation X+ và anion Y2- có cấu hình electron ở phân lớp ngoài cùng là 3p6. Hãy xác định vị trí của X ,Y trong bảng tuần hoàn. Hãy cho biết tính chất cơ bản của X,Y: Tính kim loại hay phi kim? Công thức oxit cao nhất? Tính chất (axit hay bazơ) của oxit? Hợp chất khí hidro (nếu có)? Công thức hidroxit tạo nên từ nguyên tố X, Y. Tính chất (axit hay bazơ) của hidroxit? Bài 4: Oxit trong đó nguyên tố R có hóa trị cao nhất là R2O5. R chiếm 91,176% khối lượng trong hợp chất khí với hiđro. Xác định tên nguyên tố R?
Bài 5: X tạo hợp chất khí với hidro là H2X. Trong oxit cao nhất, X chiếm 40% về khối lượng. Xác định tên X.
Giải giúp mình với ạ.
Mình đang cần gấp ạ.
Đồng trong tự nhiên có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình là 63,54.
a/ Xác định phần trăm của mỗi loại đồng vị.
b/ Hỏi mỗi khi có 108 nguyên tử 65Cu thì có bao nhiêu nguyên tử 63Cu?
c/ Tính phần trăm khối lượng của đồng vị 65Cu lần lượt trong Cu2O và CuCl2
Trong tự nhiên copper có 2 đồng vị 63Cu chiếm 73% và 65Cu a)Tính khối lượng 63Cu trong 7.154g Cu2O b)Tính %m Cu trong CuSO4
`a)`
\(\%m_{^{65}Cu}=100-73=27\%\)
`->M_{Cu}={63.73+65.27}/{100}=63,54(g//mol)`
`n_{Cu_2O}={7,154}/{63,54.2+16}=0,05(mol)`
`->n_{Cu}=0,1(mol)`
\(\to m_{^{63}Cu}=0,1.63,54.73\%=4,63842(g)\)
`b)`
`\%m_{Cu}={63,54}/{63,54+32+16.4}.100\%\approx 39,827\%`
Trong tự nhiên đồng có 2 đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu là 63,54. Tính thành phần % khối lượng của 63Cu trong CuSO4?
A. 28,83%.
B. 10,97%
C. 11,00%.
D. 28,74%.
Đáp án A
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y.
Ta có hpt:
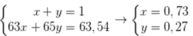
Phần trăm khối lượng của 63Cu trong CuSO4 là